
카테고리: 원하는 부분만 골라! 골라!
순서: 남들이 많이 봤던 내용들만 먼저! 먼저!
키워드 검색: 원하는 내용만 뽑아! 뽑아!
열역학 9장 밀폐계의 사이클 Pdv 와 RdT의 차이
Ch. 9 Gas Power Cycles
작성자
zxzx2578
작성일
2023-08-05 13:07
조회
234
안녕하세요 교수님, 공부하다 헷갈리는 게 있어 질문드립니다.

제가 질문드릴 문제입니다. 3 --> 1 과정에서 일을 구하는 방식(pdv, RdT)의 차이를 잘 모르겠습니다.
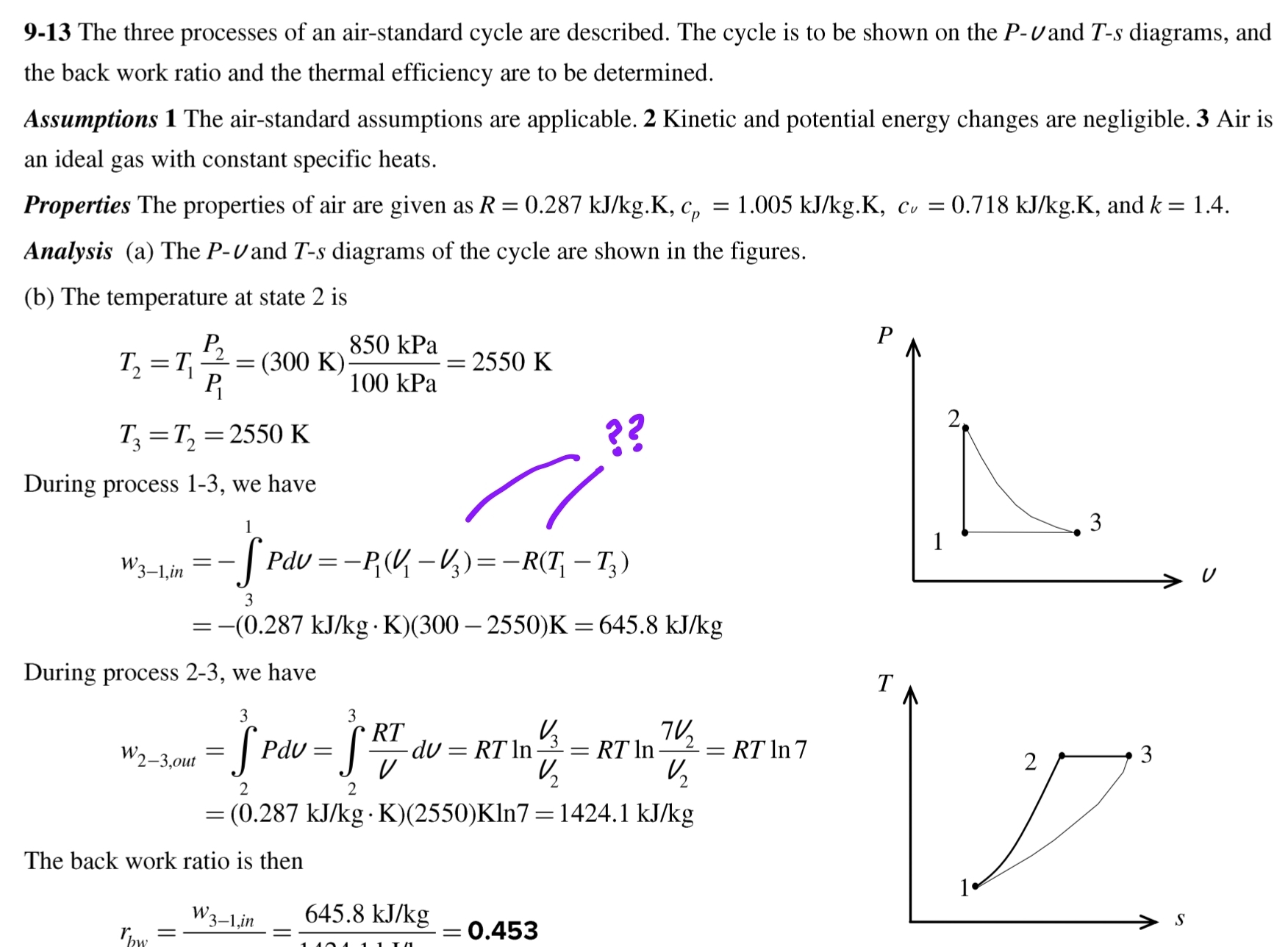
밀폐계의 3 --> 1 과정에서 일을 구하는 공식은 다음과 같습니다
W= Pdv(적분), 이때 압력이 일정하므로 W=P(v1-v3)가 됩니다.
문제에서 v1 =RT1 / P1 = 0.8614 m^3이 나오고 v3는 v1의(v2의) 7배이므로 위의 식은
W= P(v1-7*v1)이 됩니다. 이를 계산하면 W=(100)*(6)*(0.8614) = 516.858 kJ/kg 입니다.
그러나 해당 솔루션은 이상기체 방정식을 이용하여
W=P(v1-v3)를 Pv=RT를 이용해 W=R(T1-T3)로 바꾸어서 풀었습니다.
문제에서 T1은 27도로 300K, T3는 2 --> 3 과정으로 부터 2550K로 도출됩니다.
이를 위에 적용하면 W=(0.287)*(300-2550)=645.75 kJ/kg 입니다.
혹시 왜 차이가 나는 것일까요? 밀폐계의 등압과정은 엔탈피의 변화와 관련이 있는 문제인 것 같습니다만,
단순히 W=Pdv를 RdT로 바꾼 것인데 (Pv=RT 에서, 양변 미분시 Pdv+vdP=RdT (dp=0이므로) Pdv=RdT)
답이 달라지는 것이 이해가 안됩니다. 아래는 솔루션 첨부하겠습니다.
그리고 아래는 제가 푼 풀이입니다. v1를 구해서 솔루션 식의 P1(V1-V3)에 바로 대입한 것입니다.

매번 좋은 강의 올려주셔서 감사합니다~

제가 질문드릴 문제입니다. 3 --> 1 과정에서 일을 구하는 방식(pdv, RdT)의 차이를 잘 모르겠습니다.
밀폐계의 3 --> 1 과정에서 일을 구하는 공식은 다음과 같습니다
W= Pdv(적분), 이때 압력이 일정하므로 W=P(v1-v3)가 됩니다.
문제에서 v1 =RT1 / P1 = 0.8614 m^3이 나오고 v3는 v1의(v2의) 7배이므로 위의 식은
W= P(v1-7*v1)이 됩니다. 이를 계산하면 W=(100)*(6)*(0.8614) = 516.858 kJ/kg 입니다.
그러나 해당 솔루션은 이상기체 방정식을 이용하여
W=P(v1-v3)를 Pv=RT를 이용해 W=R(T1-T3)로 바꾸어서 풀었습니다.
문제에서 T1은 27도로 300K, T3는 2 --> 3 과정으로 부터 2550K로 도출됩니다.
이를 위에 적용하면 W=(0.287)*(300-2550)=645.75 kJ/kg 입니다.
혹시 왜 차이가 나는 것일까요? 밀폐계의 등압과정은 엔탈피의 변화와 관련이 있는 문제인 것 같습니다만,
단순히 W=Pdv를 RdT로 바꾼 것인데 (Pv=RT 에서, 양변 미분시 Pdv+vdP=RdT (dp=0이므로) Pdv=RdT)
답이 달라지는 것이 이해가 안됩니다. 아래는 솔루션 첨부하겠습니다.

그리고 아래는 제가 푼 풀이입니다. v1를 구해서 솔루션 식의 P1(V1-V3)에 바로 대입한 것입니다.

매번 좋은 강의 올려주셔서 감사합니다~
전체 0
댓글을 남기려면 로그인하세요.
Thermodynamics – An Engineering Approach, Cengel & Boles, McGrawHill
Ch. 1 Introduction and Basic Concepts
Ch. 2 Energy, Energy Transfer, and General Energy Analsysis
Ch. 3 Properties of Pure Substances
Ch. 4 Energy Analysis of Closed Systems
Ch. 5 Mass and Energy Analysis of Control Volumes
Ch. 6 The Second Law of Thermodynamics
Ch. 7 Entropy
Ch. 8 Exergy
Ch. 9 Gas Power Cycles
Ch. 10 Vapor and Combined Power Cycles
Ch. 11 Refrigeration Cycles
Ch. 12 Thermodynamic Property Relations
Ch. 13 Gas Mixtures
Ch. 14 Gas-Vapor Mixtures and Air-Conditioning
Ch. 15 Chemical Reactions
Ch. 16 Chemical and Phase Equilibrium
Ch. 17 Compressible Flow
- “열역학 한방에 끝내기” 는 초등학생도 이해할 수 있게끔 쉽고 재미있게 열역학을 설명하고 있습니다.
- 공식만 외워서 문제를 푸는 방식은 올바른 역학 공부법이 아니고, 조금만 응용된 문제가 나오면 접근하기가 매우 어려워져 좋은 시험 점수(좋은 학점)을 받기가 매우 어려워집니다.
- 원리와 원칙에 충실하여 어떤 문제가 나와도 개념에 충실해서 풀 수 있어야 학업성취도, 취업 면접, 대학원 시험 등에서 좋은 결과를 기대할 수 있습니다.