열역학 2법칙이 열역학 1법칙보다 어렵게 느껴지는 이유는 엔트로피의 개념이 어색하기 때문입니다. 에너지 보존법칙인 열역학 1법칙은 그래도 우리가 살면서 많이 보고 느꼈을 수 있지만, 엔트로피라는 것은 추상적으로 느껴질 수밖에 없죠. 간단한 두 가지 예제와 질문 문제를 통해 한방에 끝내봅시다.

학생분께서 질문하신 것은 간단한 것이었습니다.
왜 Q_H = -2000 kJ인가요?
하지만 부호의 문제보다 이 문제를 통해서 반드시 느끼셔야할 것은
- 엔트로피
- 엔트로피의 생성량
- 비가역성
에 대한 것입니다.
이에 대해서 열역학 제대로 끝내기에서 강의를 했었는데
간단하게 개념을 살펴보고
문제를 풀어보도록 합시다.
열역학 2법칙, 엔트로피에 대한 개념
열역학 2법칙을 이해하기 위해서는
클라우시우스 부등식
그리고
점함수로서의 엔트로피라는 정의입니다.
당연히 열역학 초반에 배우는
점함수와 경로함수의 차이에 대해 이해를 하고 계셔야겠죠.
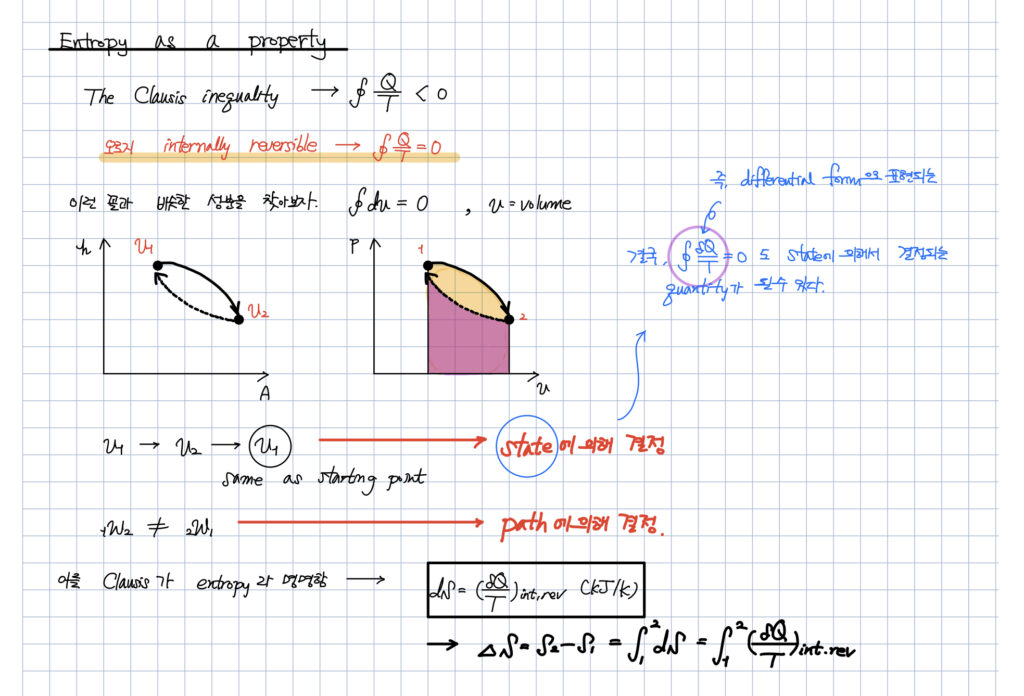
이렇게 정의된 엔트로피와
클라우시우스 부등식을 결합하여,
왜 이 세계(=우주)의 엔트로피는 항상 증가하려고 하는지에 대한
열역학 2법칙을 이해하셔야합니다.

글로만 설명하려니 이해가 어려우시죠?
다행히 이 부분에 대한 무료 강의가 아래와 같이 준비되어 있으니
위의 식을 통해 이해가 어려우셨던 분들은
꼭 강의를 들어보시길 바랍니다.
강의에는 없지만
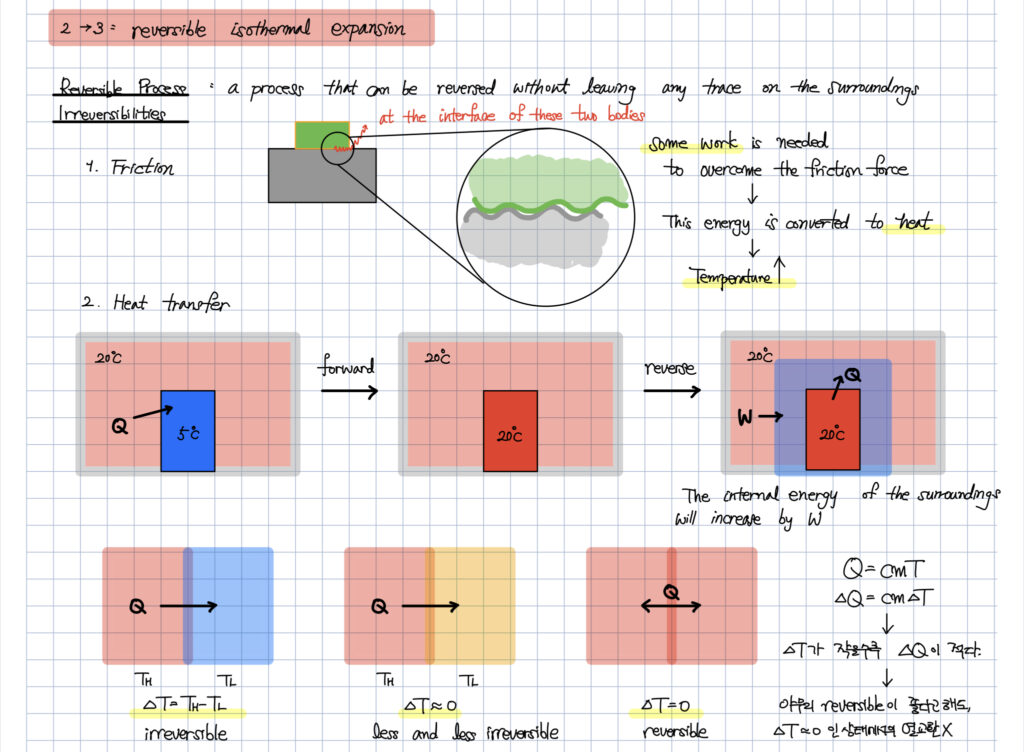
아래와 같이 대표적인 비가역과정에 대한 이해도 같이 하셔야 합니다.
(열역학 한방에 끝내기, 제대로 끝내기를 못 들으시는 분들은 꼭 교재를 같이 읽으면서 공부하시길 바랍니다.)
열전달은 대표적인 비가역 과정 중의 하나입니다.
열전달하는 두 물체 간의 온도차이가 적으면 적을수록
열전달의 방향성이 줄어들어
비가역성도 줄어들게 됩니다.
다시 한번 강조합니다.
- 열역학 1법칙=에너지 보존법칙=에너지 총합!
- 열역학 2법칙=엔트로피는 항상 증가한다=에너지 방향성!
이 내용만 가지고도
학생분께서 질문하신 문제에서
어느 시스템의 비가역성이 더 큰지 작은지는 바로 알 수 있게 됩니다.
당연히 같은 열전달이 이뤄지고 있다면,
온도차이가 적은 b 시스템의 비가역성이 a보다 작게 됩니다.
등온으로 열전달을 하는 카르노사이클이 가장 이상적일 수밖에 없는 많은 이유 중의 하나가 바로 가역과정을 가정하고 있다는 것입니다.
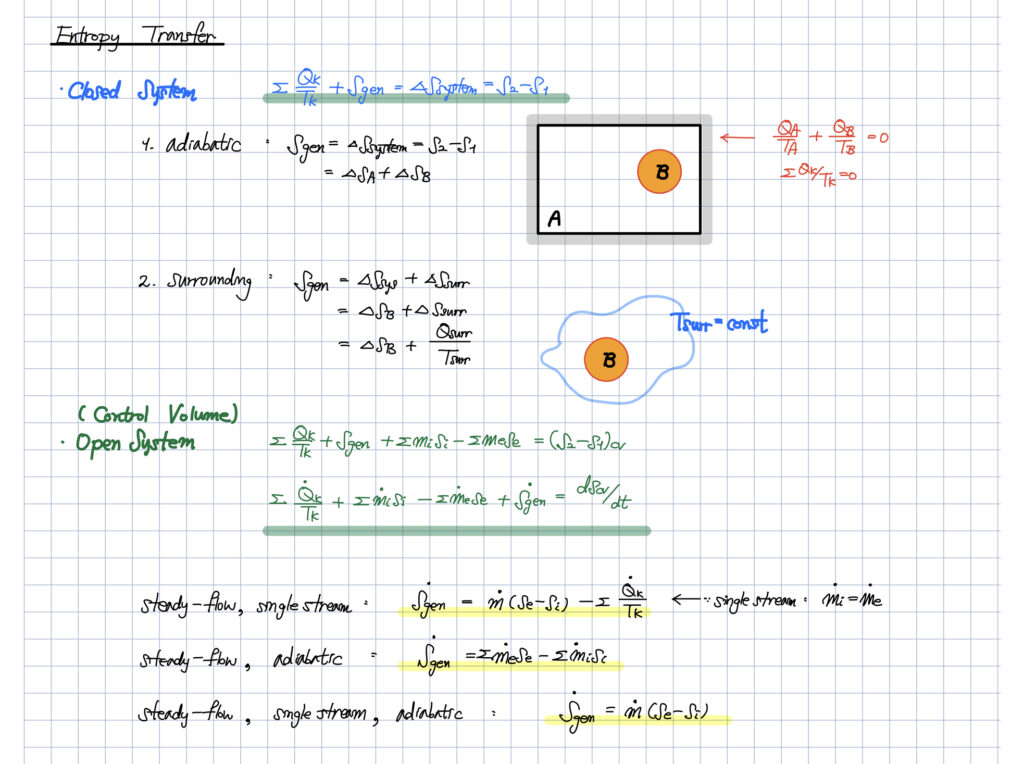
밀폐계에서의 엔트로피 전달
엔트로피의 개념에 대해 조금 이해가 되셨다면
여기에 좀더 내용을 더해서
밀폐계에서의 엔트로피가 어떻게 전달되는지를 이해할 수 있습니다.
밀폐계는 크게
- adiabatic인 경우
- surrounding이 있는 경우
로 나뉠 수 있는데 너무 복잡할 수 있기 때문에
surrounding 이 있는 경우, 없는 경우로 보셔도 무방할 것 같습니다.
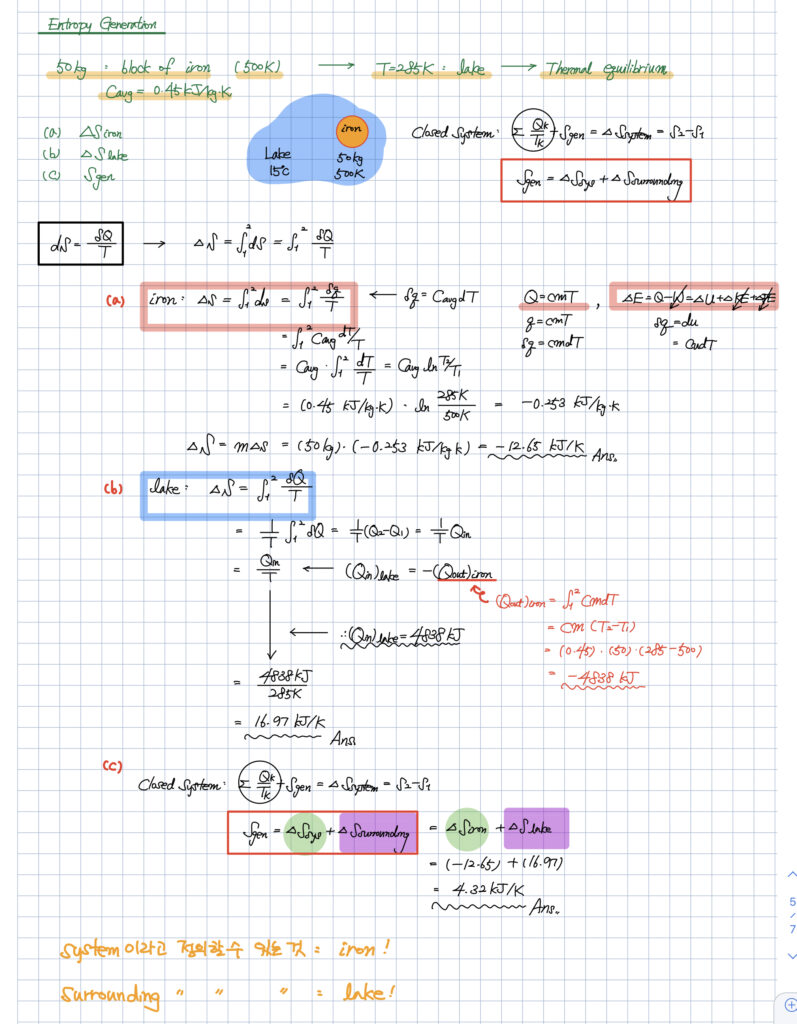
Surrounding이 있는 경우
아래와 같이 뜨겁게 달궈진 철 덩어리가
호수 속에 들어가서 식는 과정을 생각해봅시다.
호수는 어떤 시스템으로 정의하기 보다는
철 덩어리의 주위(=surrounding)라고 보는 것이 좋아 보입니다.
때문에 열을 뺏기는 철 덩어리의 경우 엔트로피가 감소하게 되고,
열을 얻은 surrounding인 호수의 경우 엔트로피가 증가하게 됩니다.
열역학 2법칙은
우주의 엔트로피는 항상 증가한다는 것이기 때문에
우주, 즉 이 세계를 정의한다고 하면,
내가 관심있는 시스템 + surrounding이 될 것입니다.
여기서
- 시스템은 iron
- surrounding은 호수
가 되겠습니다.
엔트로피의 증감량을 모두 더해보니,
4.32 kJ/K로 양수가 나온 것을 할 수 있습니다.
역시 비가역 과정의 대표적인 예인
열전달 과정이기 때문에
전체의 엔트로피가 증가하는 모습을 보이고 있습니다.
Surrounding이 있는 경우
아주 비슷한 문제인데,
surrounding이 없는 경우는 무엇일까요?
(adiabatic이라고 말한 경우)
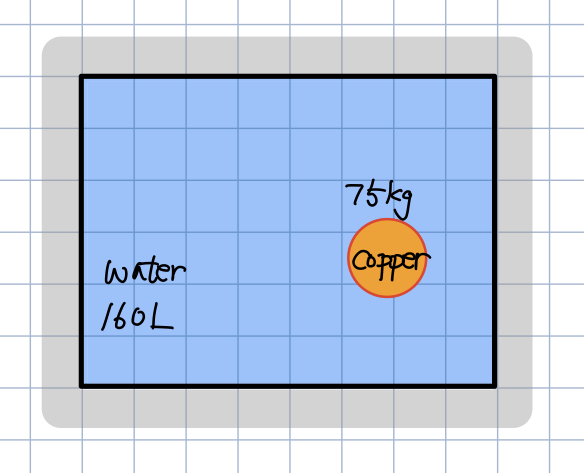
마찬가지로 뜨겁게 달궈진 구리 구슬을
물 속에서 식히는 과정이긴 한데
이번에는 호수가 아니라
용기 속에 담긴 물 속에서 식혀본다고 합시다.
각 열전달량과 엔트로피 변화량은 똑같이 계산할 수 있을 겁니다.
여기서의 차이는
시스템으로써 구리구슬과 물을 동시에 볼 수 있다는 것이고,
surrounding은 없다고 볼 수 있는 것입니다.
학생들 중에
“그냥 다 더하면 되는 거 아니야?”
라면서 아무 생각 없이 엔트로피 증감률을 더하기만 한다면
조금이라도 어렵게 응용되는 문제의 경우 간단한 개념 오류로 인해 틀리실 수 있습니다.
반드시 어떤 요소가 어떤 부분에 해당하는지 확실하게 공부를 해보시길 바랍니다.

질문에 대한 답변
위의 두 문제를 잘 이해했다면,
처음에 학생분께서 질문하신 내용은 이제 정말 쉬운 질문이 됩니다.
- 엔트로피의 정의
- 엔트로피 생성량에 대한 정의
를 잘 기억한 상태에서
시스템으로 source, sink 두 개를 잡고
surrounding은 없다(즉, 시스템과 외부는 단열이다)고 가정하고 문제를 풀면
각 경우에 대한 엔트로피 생성량을 구할 수 있습니다.
엔트로피 생성량이 더 큰
a의 경우가 비가역성이 더 크다는 것을 알 수 있겠습니다.

여러분들이 열역학을 어려워하는 이유는
처음에 설명드렸다시피
개념들이 모두 어색해서 그렇습니다.
살면서 내가 온도나 압력, 부피는 많이 썼지만…
엔트로피라는 걸 언제 생각이나 해봤겠어요?
여러분들이 열역학을 어려워하는 것은 당연합니다.
하지만
열역학 한방에 끝내기에서
강의한 것처럼
대표적인 예제를 중점으로
개념과 이론을 이해하는 방식으로 공부할 수 있다면
그 어색한 열역학 개념들도
쉽게 이해하실 수 있을 거라 생각합니다.
이 포스팅이 열역학 2법칙과 엔트로피에 대해 이해하는 데에
도움이 되었으면 하는 바람입니다.
열심히 공부하시길 바랍니다.
감사합니다.