
카테고리: 원하는 부분만 골라! 골라!
순서: 남들이 많이 봤던 내용들만 먼저! 먼저!
키워드 검색: 원하는 내용만 뽑아! 뽑아!
Re:C_p와 온도와의 관계 (Trial & Error 로 상태량표 보는 방법)
작성자
kwonjunpyo
작성일
2020-05-13 17:35
조회
2411
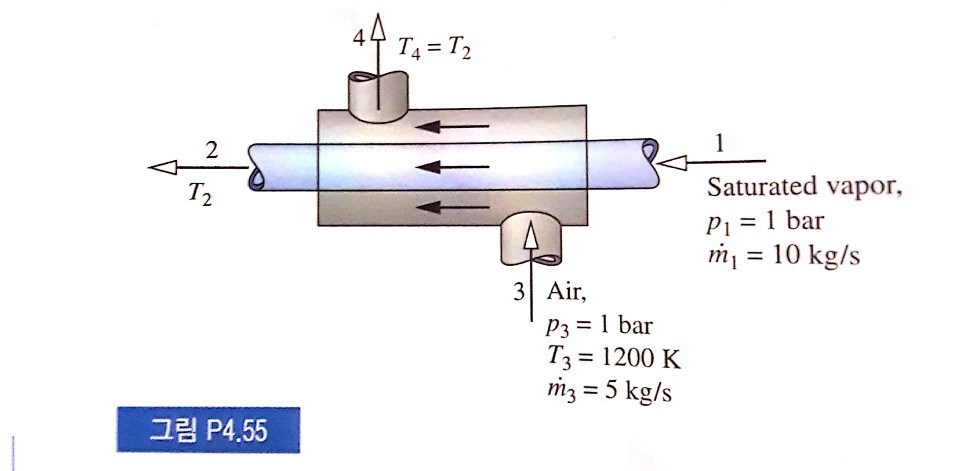
제가 궁금했던 것은 첫번째로, air의 정압비열을 구할때 들어가는 온도만이 air의 C_p에 를 정하는데 영향을 끼치는지가 궁금합니다. (여기서는 나가는 온도는 정확히 안주어져 있어서 정확히 몰라도 들어가는 AIR 온도만으로 알 수 있는지가 궁금했습니다.) 저 같은 경우는 평소 들어갈때의 온도에 대한 정압비열과 나갈때의 온도에 대한 정압비열의 산술평균으로 구하는 것으로 구했는데 구하는 방식이 틀린건가요?
두번째로는 뒤에 table을 보고 1200K를 찾아보았는데 제가 가지고 있는 TABLE(Ideal gas specific heats of some common gases)에는 1000K 밖에 없어서 이럴땐 어떻게 처리 해야 할지 궁금합니다.
마지막으로 1번에서 들어가는 물질이 sat vapor 인데 2에서 나올때는 3-4튜브로 인해 열을 받아 vapor 형태를 가진다고 생각하면 맞는지도 궁금합니다. (열교환기에서 차가운 쪽은 따뜻해지므로)
만약 맞다면 물의 vapor는 이상기체라고 문제에서 주지 않았는데 이상기체가 아니면 h_2-h_1=Cp(T_2-T_1 의
식을 못쓰는게 아닌지도 궁금합니다. (비압축성도 이상기체도 아니므로)
다음에 질문 할 땐 조금 더 질문을 정확하고 다듬어서 올리겠습니다!
추가로 책은 wiley Moran's principle of engineering thermodynamics 9판에 SI version 입니다!

두번째로는 뒤에 table을 보고 1200K를 찾아보았는데 제가 가지고 있는 TABLE(Ideal gas specific heats of some common gases)에는 1000K 밖에 없어서 이럴땐 어떻게 처리 해야 할지 궁금합니다.
마지막으로 1번에서 들어가는 물질이 sat vapor 인데 2에서 나올때는 3-4튜브로 인해 열을 받아 vapor 형태를 가진다고 생각하면 맞는지도 궁금합니다. (열교환기에서 차가운 쪽은 따뜻해지므로)
만약 맞다면 물의 vapor는 이상기체라고 문제에서 주지 않았는데 이상기체가 아니면 h_2-h_1=Cp(T_2-T_1 의
식을 못쓰는게 아닌지도 궁금합니다. (비압축성도 이상기체도 아니므로)
다음에 질문 할 땐 조금 더 질문을 정확하고 다듬어서 올리겠습니다!
추가로 책은 wiley Moran's principle of engineering thermodynamics 9판에 SI version 입니다!


Thermodynamics – An Engineering Approach, Cengel & Boles, McGrawHill
Ch. 1 Introduction and Basic Concepts
Ch. 2 Energy, Energy Transfer, and General Energy Analsysis
Ch. 3 Properties of Pure Substances
Ch. 4 Energy Analysis of Closed Systems
Ch. 5 Mass and Energy Analysis of Control Volumes
Ch. 6 The Second Law of Thermodynamics
Ch. 7 Entropy
Ch. 8 Exergy
Ch. 9 Gas Power Cycles
Ch. 10 Vapor and Combined Power Cycles
Ch. 11 Refrigeration Cycles
Ch. 12 Thermodynamic Property Relations
Ch. 13 Gas Mixtures
Ch. 14 Gas-Vapor Mixtures and Air-Conditioning
Ch. 15 Chemical Reactions
Ch. 16 Chemical and Phase Equilibrium
Ch. 17 Compressible Flow
- “열역학 한방에 끝내기” 는 초등학생도 이해할 수 있게끔 쉽고 재미있게 열역학을 설명하고 있습니다.
- 공식만 외워서 문제를 푸는 방식은 올바른 역학 공부법이 아니고, 조금만 응용된 문제가 나오면 접근하기가 매우 어려워져 좋은 시험 점수(좋은 학점)을 받기가 매우 어려워집니다.
- 원리와 원칙에 충실하여 어떤 문제가 나와도 개념에 충실해서 풀 수 있어야 학업성취도, 취업 면접, 대학원 시험 등에서 좋은 결과를 기대할 수 있습니다.
흔하지는 않지만 가끔 열역학 시험에 자주 등장하는 방법인데요.
바로 Trial and Error 방법입니다.
여러가지 시행착오를 거쳐 온도를 예측하는 것입니다.
대충 온도가 몇일 것이다고 예측한 다음에 그 온도를 가지고 엔탈피를 구하고
그 때의 온도, 그 때의 엔탈피를 대입했을 때 전체 에너지 평형식이 성립하는지를 확인하는 방법이 되겠습니다.
몇도가 될 지는 모르겠지만 일단 240C가 된다고 가정해봅시다.
240일 때는 1132.8이 나와서 0이라고 하기엔 지나치게 큰 숫자가 나왔습니다.
그렇기 때문에 더 높은 값을 대입해봅시다.
이번엔 280C를 넣어봅시다.
107.37이 나오네요. 아직 좀 커보입니다.
285C를 넣어보죠.
-925.03이 나옵니다.
지나치게 큰 온도 값을 넣었다는 의미겠네요.
그러면 조금 작은 값인 282C를 넣어봅시다.
.
.
.
.
결국 이런 식으로 하다보면 우리는 0과 최대한 가까운 값을 갖게 되는 온도값을 추측할 수 있게되고,
대략적으로 284C라는 결론을 얻게 됩니다.
Trial & Error은 자주 나오는 방법은 아닌데,
가끔씩 어려운 시험에서 한두번씩 나오는 것 같습니다.
정보가 제한적이기 때문에 이렇게 푸는 방법이 최선일 것입니다.
그래도 어제 물을 이상기체라고 가정한 값보다는 훨씬 그럴듯한 온도값이 나온 것 같습니다.
질문에 답이 됐기를 바랍니다. 감사합니다.
어제 제대로 된 정보가 없어서 문제를 제대로 풀지 못했는데
이번에는 조금 풀 수 있을 것 같습니다.
일단 어제 풀이에서 저는 공기뿐만 아니라 sat. vapor도 이상기체라고 가정했기 때문에
정확한 계산이라고 할 수 없었습니다.
일단 위에 올려주신 정보가 모든 정보라고 하면,
일단 몇가지 가정과 수증기 상태량표를 이용할 수밖에 없을 것 같습니다.
일단 내용을 하나하나 정리해보겠습니다.
어제와 거의 같고
차이 하나는 수증기를 이상기체로 보지 않는다는 점입니다.
dh=CpdT라는 식은 엔탈피가 온도만의 함수일 때 가능한 것이고,
엘탈피가 온도만의 함수는 오로지 이상기체에서만 가능하기 때문에
수증기는 수증기표를 이용하고,
공기는 이상기체임을 가정하여 정압비열을 이용해서 풀도록 하겠습니다.
수증기표를 이용하여 수증기의 엔탈피를 구해주고,
표를 이용해서 공기의 비열을 찾아 줍니다.
안타깝게 1200 K 에서의 비열값은 존재하지 않기 때문에
그나마 비슷한 1000 K 에서의 비열값을 사용하도록 하겠습니다.
(가정1: 1200 K 에서의 비열값은 1000 K 에서의 비열값과 같다)
문제는 2번 상태에서 온도를 구해야 하는데,
온도와 압력이 주어져있지 않기 때문에 엔탈피를 구하는 것이 불가능하다는 것입니다.
상태량표를 보기 위해서는 일단 온도와 압력을 알아야하기 때문이죠.
그렇다면 여기서 2 가지 더 가정을 해야 합니다,
가정2: sat. vapors는 1200 K의 공기와 열교환을 하면서 water는 superheated vapor가 될 것이다.
(꽤나 그럴 듯한 가정입니다. 뜨거운 공기를 만나면 에너지를 더 얻어서 saturated vapor 상태가 superheated vapor 상태로 바뀔 수 있겠죠.)
가정3: 1번과 2번의 압력이 1 bar로 같을 것이다.
(열교환기에서의 압력은 대기압과 같을 것이라는 가정이 필요하겠습니다. 최소한 압력이 주어져야 상태량표를 볼 수 있으니까요.)
지금까지 우리는 3가지의 가정을 했지만, 안타깝게도 아직 우리는 온도를 모르기 때문에 상태량표를 확인할 수가 없습니다.
가정2를 통해 superheated table을 봐야한다는 결론을 얻었고,
가정3을 통해 압력을 1 bar라고 생각할 수 있었지만,
아직 온도를 모르기 때문에 엔탈피를 구할 수 없습니다.
사실 온도를 구하는 것이 최종 문제이기 때문에 아이러니한 상황입니다.
식은 하나인데 모르는 것이 2개인 상황이죠.