
카테고리: 원하는 부분만 골라! 골라!
순서: 남들이 많이 봤던 내용들만 먼저! 먼저!
키워드 검색: 원하는 내용만 뽑아! 뽑아!
정압 과정
Ch. 3 Properties of Pure Substances
작성자
hjung0215
작성일
2020-10-29 07:13
조회
2414
!!!!!!!!일단 절대 과제 아닙니다!!!!!!!!!!
저번에 상태량 구하기 질문을 올리고 나서 문제를 다시 풀어 보고나서
아직까지도 이해가 되지 않는 부분이 있어서 작성을 하게되었습니다.
제가 이해를 한만큼 적어 보자면
Q라는 열량을 피스톤 - 실린더에 유입을 시키면 U의 증가로 분자의 활성도가 높아지면서 P_in이 증가 하게되고 P_in > P_atm 가 된다. 그리고 P_in == P_atm이 될때까지 체적이 증가 하게된다. 이걸 준평형과정에 빗데어 보자면 미소량의 q의 유입으로 P_in > P_atm가 되고 미소 체적이 증가하면서 바로 P_in == P_atm이된다. 즉 P의 미소변화가 일어나고 다시 P로 복구가 되기때문에 등압과정이라고 봐도 무방하다.
라고 이해를 해봤습니다.
그래서 저번 질문에 첫번쨰 문제가 왜 정압 과정으로 풀어도 되는지 이해가 되었습니다.
근데 두번째 문제는 아직도 이해가 가질 않습니다.
 1상태 : T : 200, M: 1.4kg => sat.liquid이기 때문에 여기서 P1을 구해보면 1554.9kpa
1상태 : T : 200, M: 1.4kg => sat.liquid이기 때문에 여기서 P1을 구해보면 1554.9kpa
2상태 : V2 = 4V1 ==> sat.vapor일때 비체적2를 구해서 P2를 구해보면 21.224Kpa 나옵니다.
여기서 이해가 안됩니다. 정압과정 이라는 것이 과정중에 압력이 일정하게 유지된다 라고 알고 있습니다. 그렇다는거는 피스톤 - 실린더 과정도 정압과정으로 두고 문제를 해석하게되면 P1 == P2가 같아야 하는거 아닌가요?
이거에 대해서 나름 고민을 해봤는데 q = u + pv 이고 p = const. 하게 되면 T와 v만 증가를 하게되고, 이걸 P-v선도로 그려보면 아래와 같이 될거라고 예상해봤는데요. 근데 이렇게되면 P_1 != P_2 가 되는데 이러면 등압과정이 아닌게 되버리는 거 아닌가라는 생각도 해봤고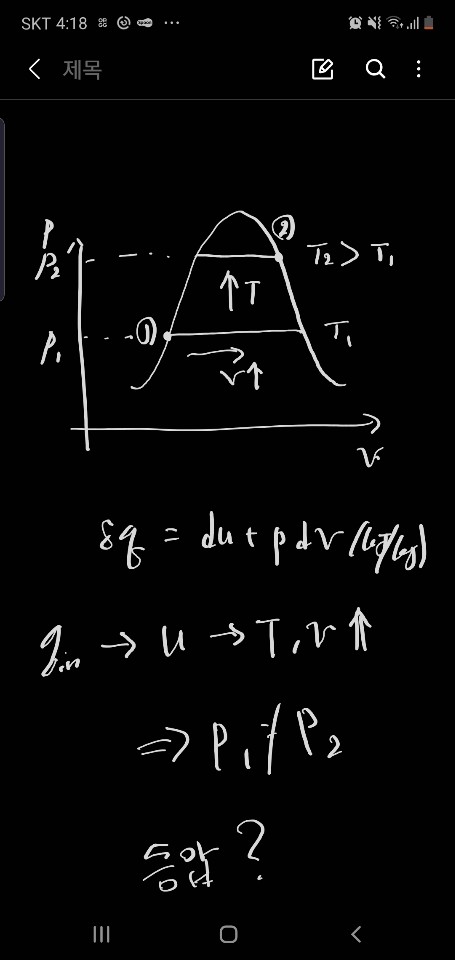
이게 sat vapor + liquid와 superheated vapor일때의 정압과정에 어떤 차이가 있나 라고 생각을 해서 그래프를 아래와 같이 그려 봤습니다. 과열증기 일때는 그래프상으로도 이해가 되었습니다.
근데 포화액에서 포화증기로의 등압과정(p = const.)에서는 제가 생각하는 등압과정은 1->2로 진행되야한다고 생각을 하는데 문제에서는 1->2'로 진행을 하고있습니다.
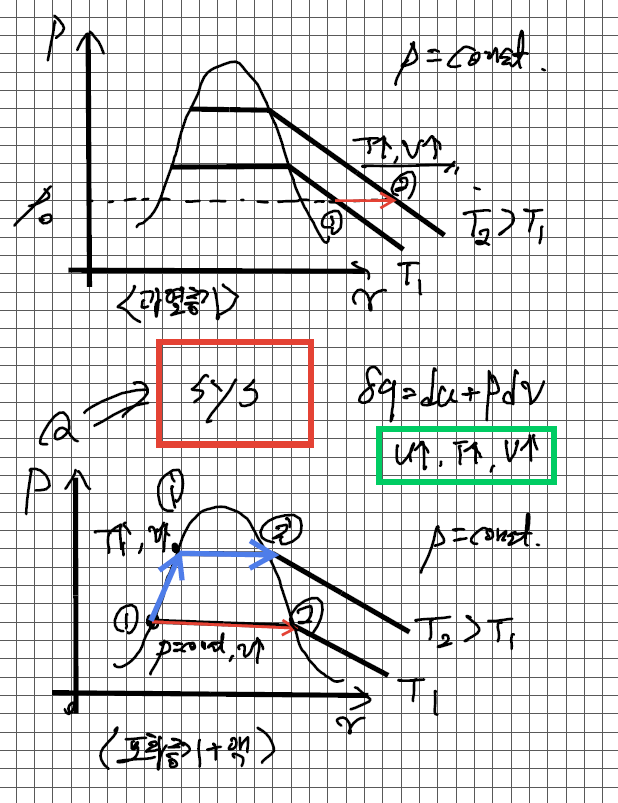
이거에 대해서도 고민을 해봤는데 1 -> 2'과정에서 1포화액에서 온도가 증가하고 체적이 증가하면서 1'포화액으로 까지 진행이 되고 그 다음 2'까지 P2로 등압과정의 상변화가 일어나서 등압과정이라고 해도 되는건가? 라는 생각도 해봤습니다.
요약해서 말씀을 드리면 등압과정은 [처음압력 == 나중압력] 인데 왜 위 문제처럼 포화액에서 포화증기로의 과정에서는 [처음압력 != 나중압력] 인지에 대해서 알고 싶습니다..
사실 금요일마다 하는 역학 콘서트?라는 곳에서 물어볼려고 했는데 학원시간이 겹쳐서 질문을 못했습니다...ㅠ 몬가 쉬운 개념 같아서 질문들이기 좀 그래서.. 혼자 힘으로 이해를 해볼려고 했는데 도무지 이해가 가지 않아 질문드립니다.
긴글 읽어주셔서 감사합니다.
저번에 상태량 구하기 질문을 올리고 나서 문제를 다시 풀어 보고나서
아직까지도 이해가 되지 않는 부분이 있어서 작성을 하게되었습니다.
제가 이해를 한만큼 적어 보자면
Q라는 열량을 피스톤 - 실린더에 유입을 시키면 U의 증가로 분자의 활성도가 높아지면서 P_in이 증가 하게되고 P_in > P_atm 가 된다. 그리고 P_in == P_atm이 될때까지 체적이 증가 하게된다. 이걸 준평형과정에 빗데어 보자면 미소량의 q의 유입으로 P_in > P_atm가 되고 미소 체적이 증가하면서 바로 P_in == P_atm이된다. 즉 P의 미소변화가 일어나고 다시 P로 복구가 되기때문에 등압과정이라고 봐도 무방하다.
라고 이해를 해봤습니다.
그래서 저번 질문에 첫번쨰 문제가 왜 정압 과정으로 풀어도 되는지 이해가 되었습니다.
근데 두번째 문제는 아직도 이해가 가질 않습니다.
 1상태 : T : 200, M: 1.4kg => sat.liquid이기 때문에 여기서 P1을 구해보면 1554.9kpa
1상태 : T : 200, M: 1.4kg => sat.liquid이기 때문에 여기서 P1을 구해보면 1554.9kpa2상태 : V2 = 4V1 ==> sat.vapor일때 비체적2를 구해서 P2를 구해보면 21.224Kpa 나옵니다.
여기서 이해가 안됩니다. 정압과정 이라는 것이 과정중에 압력이 일정하게 유지된다 라고 알고 있습니다. 그렇다는거는 피스톤 - 실린더 과정도 정압과정으로 두고 문제를 해석하게되면 P1 == P2가 같아야 하는거 아닌가요?
이거에 대해서 나름 고민을 해봤는데 q = u + pv 이고 p = const. 하게 되면 T와 v만 증가를 하게되고, 이걸 P-v선도로 그려보면 아래와 같이 될거라고 예상해봤는데요. 근데 이렇게되면 P_1 != P_2 가 되는데 이러면 등압과정이 아닌게 되버리는 거 아닌가라는 생각도 해봤고

이게 sat vapor + liquid와 superheated vapor일때의 정압과정에 어떤 차이가 있나 라고 생각을 해서 그래프를 아래와 같이 그려 봤습니다. 과열증기 일때는 그래프상으로도 이해가 되었습니다.
근데 포화액에서 포화증기로의 등압과정(p = const.)에서는 제가 생각하는 등압과정은 1->2로 진행되야한다고 생각을 하는데 문제에서는 1->2'로 진행을 하고있습니다.

이거에 대해서도 고민을 해봤는데 1 -> 2'과정에서 1포화액에서 온도가 증가하고 체적이 증가하면서 1'포화액으로 까지 진행이 되고 그 다음 2'까지 P2로 등압과정의 상변화가 일어나서 등압과정이라고 해도 되는건가? 라는 생각도 해봤습니다.
요약해서 말씀을 드리면 등압과정은 [처음압력 == 나중압력] 인데 왜 위 문제처럼 포화액에서 포화증기로의 과정에서는 [처음압력 != 나중압력] 인지에 대해서 알고 싶습니다..
사실 금요일마다 하는 역학 콘서트?라는 곳에서 물어볼려고 했는데 학원시간이 겹쳐서 질문을 못했습니다...ㅠ 몬가 쉬운 개념 같아서 질문들이기 좀 그래서.. 혼자 힘으로 이해를 해볼려고 했는데 도무지 이해가 가지 않아 질문드립니다.
긴글 읽어주셔서 감사합니다.
Thermodynamics – An Engineering Approach, Cengel & Boles, McGrawHill
Ch. 1 Introduction and Basic Concepts
Ch. 2 Energy, Energy Transfer, and General Energy Analsysis
Ch. 3 Properties of Pure Substances
Ch. 4 Energy Analysis of Closed Systems
Ch. 5 Mass and Energy Analysis of Control Volumes
Ch. 6 The Second Law of Thermodynamics
Ch. 7 Entropy
Ch. 8 Exergy
Ch. 9 Gas Power Cycles
Ch. 10 Vapor and Combined Power Cycles
Ch. 11 Refrigeration Cycles
Ch. 12 Thermodynamic Property Relations
Ch. 13 Gas Mixtures
Ch. 14 Gas-Vapor Mixtures and Air-Conditioning
Ch. 15 Chemical Reactions
Ch. 16 Chemical and Phase Equilibrium
Ch. 17 Compressible Flow
- “열역학 한방에 끝내기” 는 초등학생도 이해할 수 있게끔 쉽고 재미있게 열역학을 설명하고 있습니다.
- 공식만 외워서 문제를 푸는 방식은 올바른 역학 공부법이 아니고, 조금만 응용된 문제가 나오면 접근하기가 매우 어려워져 좋은 시험 점수(좋은 학점)을 받기가 매우 어려워집니다.
- 원리와 원칙에 충실하여 어떤 문제가 나와도 개념에 충실해서 풀 수 있어야 학업성취도, 취업 면접, 대학원 시험 등에서 좋은 결과를 기대할 수 있습니다.
제가 처음에 풀었던 방법은
State 1 (Sat. Liq. @ 200˚C, 15.5 bar) -> State 2 (Sat. Vap. @ 370˚C, 210 bar)
이었습니다.
이는 솔루션에서의 풀이와 일치한 것으로 보여졌지만
압력이 15.5 bar 에서 210 bar로 바뀐다는 측면에서
실린더-피스톤이라는 조건에 의한 등압과정을 만족하지 않는다는 문제가 있었습니다.
(이 부분이 학생분께서 위에서 제기해주신 부분입니다.)
그래서 제가 실린더 조건을 100% 만족시키기 위해서
State 1 (Sat. Liq. @ 200˚C, 15.5 bar) -> State 2' (Superheated Vapor @ 370˚C, 15.5 bar)
로써 문제를 다시 풀어보려고 했습니다.
하지만 여기서의 문제는
2번째의 state에서
1번째 state 부피의 4배가 된다는 문제에서의 조건을 만족시킬 수 없음을 알게 됐습니다.
(아예 상태량표에서 제공되지 않는 것으로 15.5 bar에서는 그렇게 낮은 부피를 갖는 것이 현실적으로 불가능한 것으로 보입니다.)
그렇다면 여기서 추가적으로 고민거리가 생깁니다.
1. 실린더 문제에는 제공된 열이 "내부에너지의 증가" + "경계일의 증가" 를 야기하고,
2. Rigid Tank문제에는 제공된 열이 "내부에너지의 증가" 만 야기할텐데,
"왜 두 문제에서의 내부에너지 증가량은 동일할까" 하는 점입니다.
이건 제 생각인데요.
아마 두 문제를 궁극적으로 연결해서 진짜 의미있는 결론을 내려면
단순히 최종 내부에너지 증가량을 구하는 문제에서 끝낼 것이 아니라
두 문제에서 제공된 열의 양을 비교하는 식으로 문제를 내야할 것 같습니다.
실린더 문제에서는
열에 의해
분명히 내부에너지 + 경계일이 모두 증가하고 있고,
Rigid Tank 문제에서는
열에 의해 내부에너지만 증가하고 있습니다.
문제에서 얼마의 Q가 넣어졌는지 나와있지는 않지만,
분명 실린더에서의 열량이
rigid tank에서의 열량보다
클 수밖에 없을 겁니다.
(증가하는 경계일을 고려해줘야하기 때문이죠. 그리고 이때의 경계일은 단순히 Patm에 의한 일이 아닐 것입니다. 준평형과정이 아닌 것으로 보이기 때문이죠.)
이 챕터가 상태량표를 보는 것을 연습시키는 3단원으로 보이기 때문에
위와 같은 자세한 고민은 불필요해보이긴 하지만
정말 좋은 고민이고, 저도 많이 생각했습니다.
저도 정확하지 않아서 완벽하게 결론내기는 어려운데요.
나중에 역학 콘서트 등을 이용해서
같이 고민해보는 시간을 가지면 더욱 좋을 것 같습니다.
덕분에 저도 많이 고민하며 즐거웠습니다.
앞으로도 좋은 질문 많이 해주시길 바랍니다.
안녕하세요.
자세하게 생각을 알려주셔서 감사하고,
저도 덕분에 이 문제에 대해 많은 고민을 했습니다.
결론부터 말씀드리자면,
실린더-피스톤의 경계조건을 갖고 있는 경우
등압과정으로 보는 것이
준평형과정을 기준으로 볼 때 합당하나
이 문제에서는 비록 실린더라고 할 지라도
등압과정으로 보는 것이 어렵다는 것입니다.
아래의 그림을 먼저 보시길 바랍니다.
때문에 제가 내릴 수 있는 결론은 아래와 같습니다.
1. 기본적으로 실린더 문제는 등압으로 가정해야 하지만,
2. 이 문제의 경우 준평형과정으로 보기 어렵기 때문에 압력이 바뀌는 상황을 고려해야 한다.
3. dE = Q - W = dU이기 때문에 Q = dU + W = dU + d(PV) 로 정의될 수 있다.
4. 제공되는 열에너지가 "내부에너지의 증가" + "경계일의 증가" 로 연결되고,
5. 기본적으로 준평형과정일 때는 경계일이 등압과정에서의 일 증가로 계산되지만, 이 문제에서는 압력 또한 가변적일 수 있다는 것을 고려해야 한다.