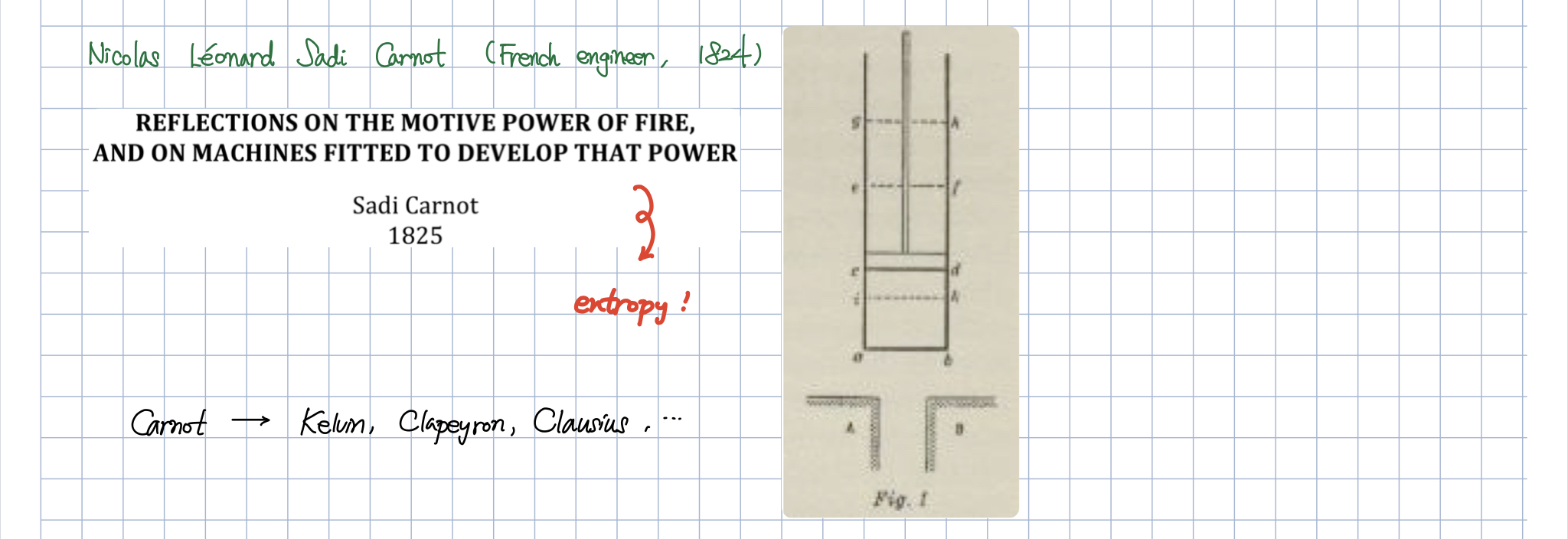
카르노 사이클이 세상에 존재할 수 없는 이상적인 사이클이라고 들었습니다. 어떤 사이클보다 최고의 효율을 갖고 있고 카르노 사이클보다 더 높은 효율을 갖는 사이클은 존재하지 않는다고 하셨어요. 하지만 그 이유가 정확히 무엇일까요?
그리고 아래 강의의 마지막 질문에 대한 답을 알고 싶습니다.
답변
카르노 사이클은 강의에서 많이 설명드렸다시피,
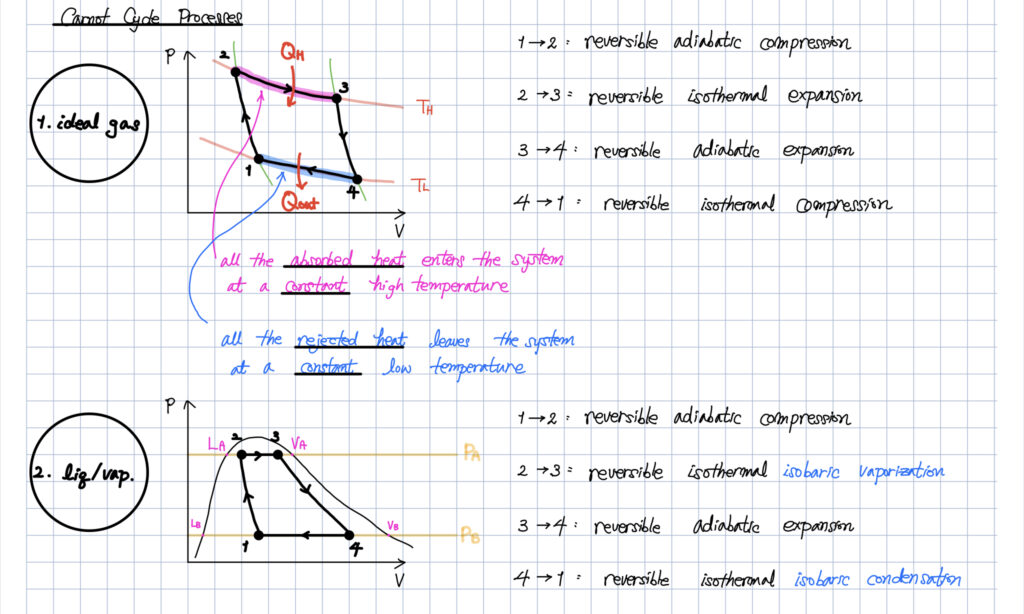
카르노 사이클(ideal gas)은 총 4 가지의 운동 형태를 갖습니다.
- 가역 단열 압축
- 가역 등온 팽창
- 가역 단열 팽창
- 가역 등온 압축
이 과정 자체가 모순 덩어리인 말도 안되는 가정이고
이상적인 upper threshold (최대 기준값) 을 제공할 뿐
현실적으로 실현될 수 없는 기관임을 아실 겁니다.
여러 가지 내용이 있겠지만,
개인적으로 생각하는 가장 중요한 2 가지 결론만 말씀드리면 아래와 같겠습니다.
- 열전달 과정은 대표적인 비가역 과정 중에 하나이다.
- 등온 과정은 시스템이 열을 받아서 최대 일을 만들 수 있는 열역학적 과정이다.
위의 유투브 영상에서 보셨겠지만,
카르노 사이클의 열효율이 최대라는 사실은
열역학 제 2법칙을 통해 충분히 증명해드린 바 있습니다.
하지만 결국
카르노 사이클의 각 과정이 갖는
열역학적 과정에 대한 이해를 하지 못하면
왜 이 사이클이 열역학적으로 이상적인 사이클인지 알 수가 없습니다.
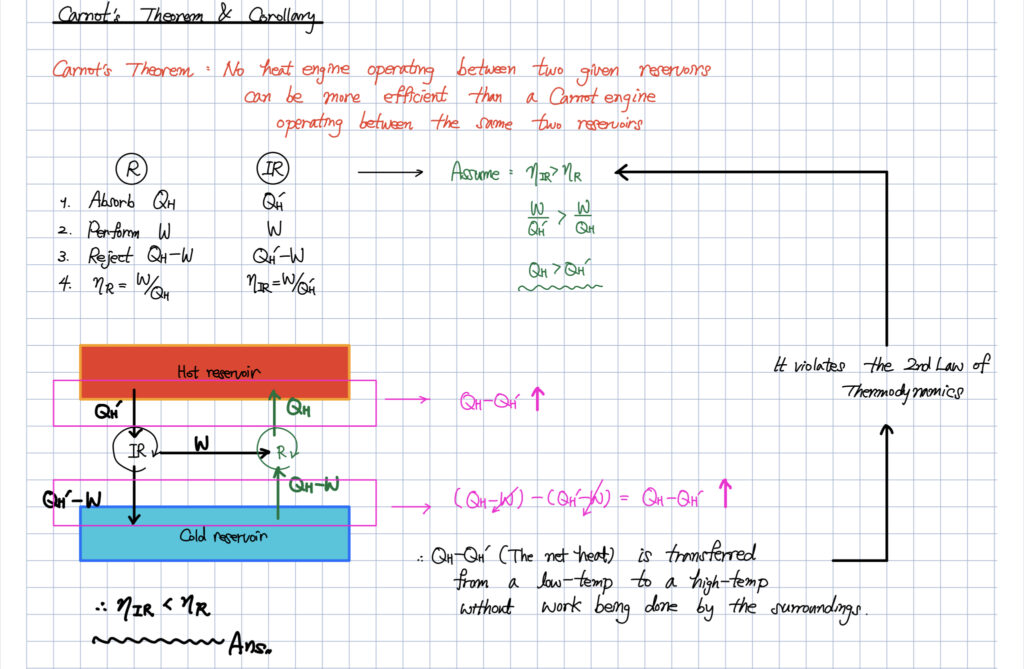
카르노 사이클의 가장 중요한 특징 3 가지를 뽑으면 아래와 같습니다.
Carnot cycle’s essential characteristics
- 가역과정
- 두 열원 사이에서 운전되는 사이클이며 등온과정으로 열전달이 진행됨. (열을 받을 때는 가장 높은 온도에서 열을 흡수하고, 열을 방출할 때는 가장 낮은 온도에서 열을 방출함.)
- 작동 물질에 무관하다.
이러한 특징들이
카르노 사이클을 특별하게 만드는 겁니다.

일단 가역과정에 대한 이해가 필요할 것 같습니다.
가역과정은 여러분들도 아시겠지만
주위에 변화를 남기지 않고,
언제든 돌아올 수 있는 이상적인 과정을 말합니다.
주위에 어떠한 변화를 남기지 않고 과정이 진행되기 때문에
과정 중에 엔트로피의 변화량이 0가 되겠습니다.
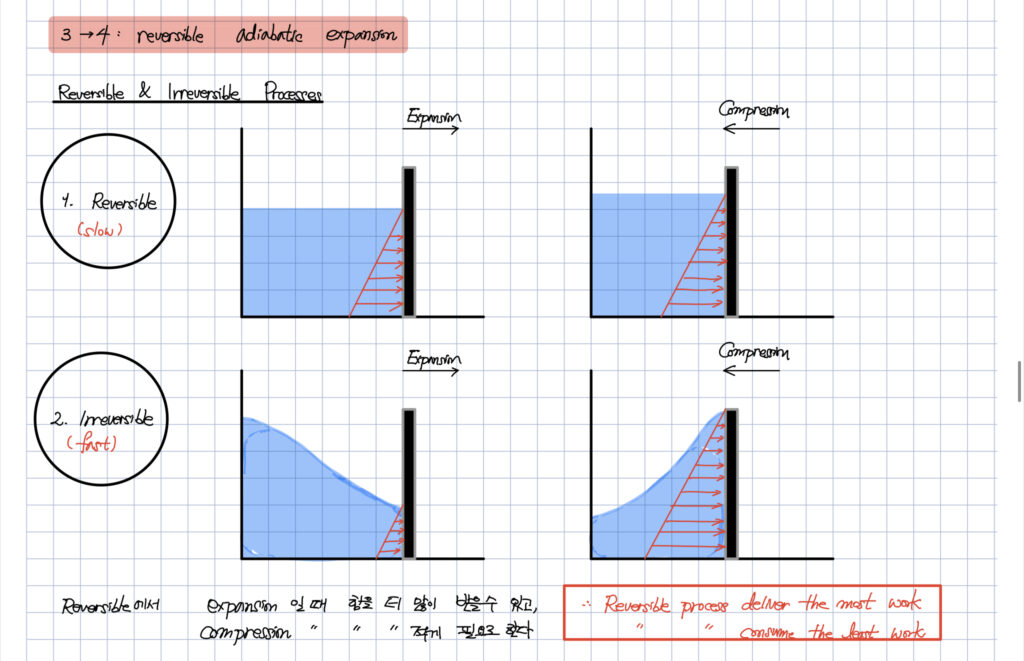
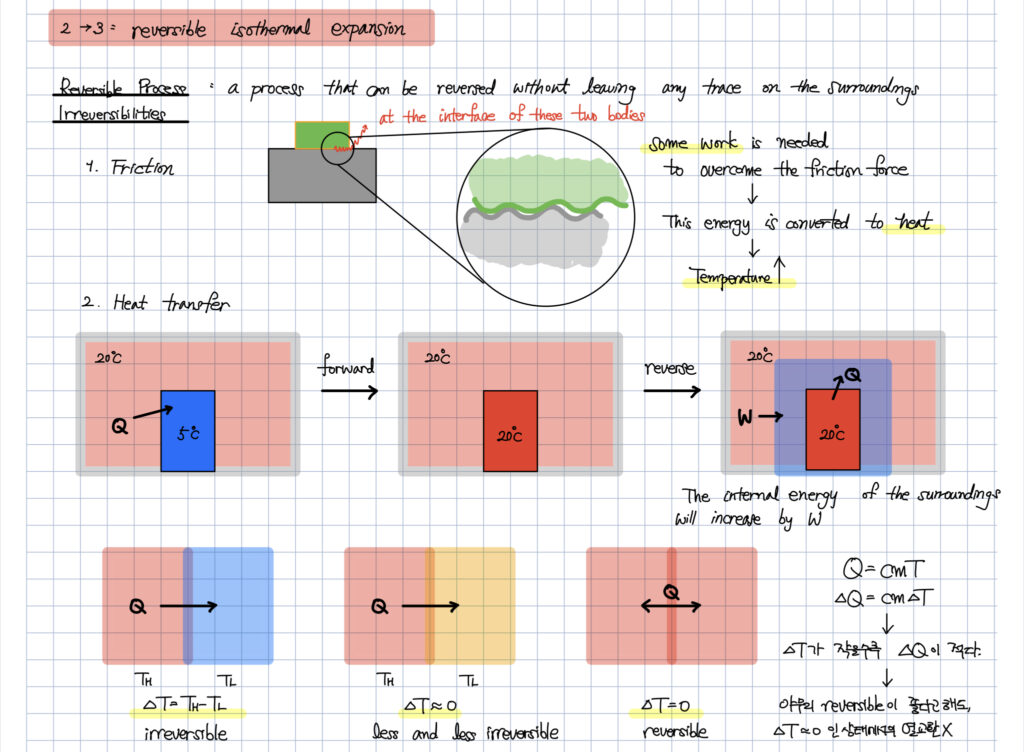
아래의 그림은
quasi-static (준평형) 과정이 왜 reversible 로 간주될 수 있는가에 관한 내용입니다.
그리고 반대인 fast process 는 irreverisble 로 간주될 수 있음을 알려줍니다.
그렇다면 기본적으로 가역과정을 가정하는
카르노 사이클은
분명 현실에서 존재할 수 없는 이상적인 사이클인 첫 번째 이유가 됩니다.
두 번째로 등온과정에서의 열전달 인데요.
열전달은 기본적으로 비가역 과정입니다.
그렇지만 카르노 사이클은
열원과 시스템 사이의 열전달이
같은 온도 상태에서 진행된다고 말하고 있습니다.
이는 이론적으로만 가능한
이상적인 과정이라고 할 수 있겠습니다.
이에 대한 좀더 자세한 설명은
곧 오픈될 열역학 제대로 끝내기에서 확인하실 수 있겠습니다.
세번 째 이유인 작동 물질에 무관한 사이클이라는 것은 충분히 이해가 되실 것이라고 생각합니다.
좀 더 추가로 말씀드리고 싶은 내용은
열역학적 과정인데요.
열역학적 과정은 크게 4가지가 있습니다.
- 정적과정
- 등온과정
- 정압과정
- 단열과정
각 과정의 특징과 성격에 대해서 강의에서 수도 없이 강조한 바 있으나,
짧게 요약하면 아래와 같습니다.
Q = U + W = U + p \Delta{V} (열역학 제 1법칙)
- 정적과정 (no boundary work, 받은 열을 다 내부에너지로 저장한다.): Q = U + p \Delta{V} = U
- 등온과정 (no internal energy increase, 받은 열을 다 일로 전환한다): Q = U + p \Delta{V} = p \Delta{V}
- 정압과정 (받은 열을 적절하게 내부에너지 증가, 일로 변환하는데에 쓴다.): Q = U + p \Delta{V}
- 단열과정 (받은 열이 없다. 자기 내부에너지를 써서 일을 한다.): Q = U + p \Delta{V} = 0
내부에너지가 온도만의 함수라는 사실만 잘 인지하고 계신다면
카르노 사이클은 기본적으로 가역이면서 등온과정에서의 열전달을 가정하고 있습니다.
이제는 이러한 특징들이 얼마나 이상적인 과정인지 아셨을 거라 생각합니다.
이상기체에 관한 자세한 설명은 아래의 링크를 통해 확인하세요.
또는 사이트에서 “이상기체”로 검색해보시길 바랍니다.
이상기체에서 내부에너지와 엔탈피는 왜 온도만의 함수인가?

아마 이제는 위에서 설명드렸던 아래의 카르노 사이클 특징에 대해
잘 이해하셨을 거라 생각합니다.
Carnot cycle’s essential characteristics
- 가역과정
- 두 열원 사이에서 운전되는 사이클이며 등온과정으로 열전달이 진행됨. (열을 받을 때는 가장 높은 온도에서 열을 흡수하고, 열을 방출할 때는 가장 낮은 온도에서 열을 방출함.)
- 작동 물질에 무관하다.
열역학은 개념이 매우 중요한 학문입니다.
절대 공식만 외워서 대충 공부하면
조금만 어려운 문제를 만났을 때 절대 해결하실 수 없을 겁니다.
반드시 책을 읽으면서 혼자서 열심히 내용을 이해해보실 것을 강력하게 권장드립니다.
질문에 대한 답이 됐기를 바랍니다.
감사합니다.