안녕하세요! 군대 제대하고….혼자서 열역학 공부하려니 너무 막막했는데 교수님 강의듣고 계속공부하며 너무 재밌어서 정말 감사함을 느끼고있습니다!!! 교수님 강의와 유튜브, 노트 그리고 다른사람들의 QnA, 그리고 제가 따로 검색해서 찾아본 정보들을 다 읽어 봤는데…아무래도 얻은정보가 많아지면서 햇갈리는 부분이 생겨서요…..정말 시원하게 알고싶은데….도와주시면 정말 감사하겠습니다 ㅠ
1. 엔트로피 평형식에서 dS=deltaQ/T 라는 공식과 dS=m*c*ln(T2/T1) 라는 식이 대표적으로 있잖아요….
dS=적분 delta Q/T + 엔트로피 생성량 이것과의 관계를 따져보게 되면, reversible 일때는 엔트로피 생성량이 없으므로, dS=deltaQ/T 라는 식이 나오게 된것이고 Incompressible Substance에서 dS=m*c*ln(T2/T1) 이러한 식이 유도되었잖아요……그래서 엔트로피 생성량을 구할때 보통, 엔트로피 생성량= m*c*ln(T2/T1)-(deltaQ/T) 이렇게 할수 있잖아요…..쉽게 예시를 들면, 호수가에 뜨거운 돌을 던지면, 처음 돌의 온도를 T1, 나중에 식은 온도를 T2로 둘수있고 그것을 m*c*ln(T2/T1) 이것에 대입할수 있잖아요……irreversible 상태 이죠 돌은… 그리고 호수는 reversible 상태로 온도를 계속 유지하므로 T가 일정하잖아요….그러므로 (deltaQ/T) 여기에 호수 온도를 T에 대입하고 Q는 돌덩이에서 m*c*delta T로 구해서 대입하면 엔트로피 생성량을 구할수있게되는데…..질의응답과 유튜브 영상 몇일에 걸쳐서 전부 봤는데 위에 제가 나열한 식들이 reversible, or irreversible 상태에 상관없이 상태량에관한 식이므로 가역과정 비가역과정, 밀폐계, 오픈계 모두 사용 가능한 식이라고 이해되었는데요(Tds 식을 유도할때 가역을 가정해서 유도가 되긴 하지만 결과적으로는 상태량들만으로 이루어진 식이므로)……여기서 궁금한것이 비가역과정에도 사용이 가능하다면…..(deltaQ/T) 여기 T에 아까와같이 온도변화가 없는 호수같은것은 그냥 온도를 넣으면 되는데……비가역과정 즉 온도가 변하 초기 온도를 넣나요 나중온도를 넣어야하나요?? 예를 들면 호수에 뜨거운돌을 넣은게 아니고 조그만 방에 넣었다고 생각할 경우요……저 식의 T가 무엇을 의미하는지 잘 모르겠네요……..원론적으로 Boundary를 통하는 온도잖아요…..근데 그것에대한 정의가 햇갈리네요…..그냥 온도의 변화량인지, 처음온도인지 나중온도인지….
매우길게 설명했지만 요약하자면 그냥 (deltaQ/T) 에서의 T 가 무엇을 뜻하는지가 알고싶네요…
2. 밀폐계에서의 일과 개방계에서의 일에대하여 질문이 있습니다……
밀폐계에서는 일을 pdv로 나타낼수있지만 개방계에서는 일이 두가지로 볼수있는데, 하나는 밀폐계에서와 같은 개념의 일, pdv형태, 그리고 또하나가 질량의 유출입으로 인한 일이 있잖아요…..즉, 오픈시스템에서 boundary를 통과하는 열에의한 다른 모든에너지에 대한것과 flow work가 있는데….. 여기서 flow Work가 엔탈피 형태로 표현되면서 1st법칙에서 열린계를 표현할때 쓰는 Q-W+mi()-me() 여기서 괄호안에 자리잡게 되잖아요…..그런데 저기에 표현되고있는 W는 그러면 공업일이라고 표현하신 vdp 인가요?? 혹시 왜 저기 W가 vdp 인지 알수있을까요?? 오픈계에서의 1법칙에서의 W는 vdp인지가 궁금하고, 왜 그런지가 궁금해요 ㅠ 이게 왜 궁금하냐면…..밀폐계에서는 단순히 부피의 변화 (외부에서 들어오는 일이 없을때 ex) paddle) 로 W=0인지 ㅏ닌지 알수 있는데…..오픈계에서는 W=0인지 아닌지를 결정하는데 제가 망설이더라고요…… (이부분은 많이 부족한 질문같네요…..죄송합니다….그래도 답변해주시면 계속 궁금해 하던게 사라질것같아요…)
3. Steady state에서 1st law에서 내부에너지 를 0으로 볼 수 있는 것을 dU=m*C*delta T 에서 steady state은 온도가 변화하지 않으니깐 내부에너지가 0이다. 또는, 열린계로 이해하면 다른 것들은 밀폐계에 존재하지않고, dE/dt가 steady state 일때,시간에따라 변하지 않으므로 0, 즉 내부에너지 0. 이렇게 이해해도 되는건가요??
4. dScv/dt=Qdot/Tb + (sigma mdot*s)in – (sigma mdot*s)exit + 엔트로피생성량
이런식으로도 2nd law (open system에서)가 정의 되있는것을 봤는데요…..교수님이 알려주신 S2-S1=integral 1to 2 (deltaQ/T)b + 엔트로피 생성량 이식과 차이가 저기 (summation mdot*s)in – (summation mdot*s)exit 이부분인데…. 이것을 어떻게 이해하면되는건가요???
질문이 너무 길고 많은데……정말 뚜렷하게 이해하고 알고싶어서요 ㅠ 바쁘실텐데…..정말 부탁드리겠습니다…
답변
친절하고 자세하게
궁금한 점을 잘 설명해주셔서 고맙습니다.
일단 질문 주신 내용에서 정정해야할 부분도 있고,
질문하는 과정에서 참고하신 내용에 대해서 정확히 파악하기 어렵기 때문에
질의응답을 효과적으로 하기 위해서는
먼저 제가 먼저 질문하신 토픽에 대한 답변을 드리고
이 답변에 대해 추가적인 궁금증이 있다면
추가적으로 해주시는 것이 가장 좋은 방법일 것이라고 생각합니다.
첫 번째 질문에 대한 답변
질문하신 내용에 대해서
제가 올린 무료 유튜브 강의 영상이
정말 자세하게 소개하고 있습니다.
학생분께서 제 강의와 유튜브도 보신 후에 질문을 주셨다고 했는데
보신 유튜브가 제 유투브 컨텐츠인지 불확실하여
이전에 올려드렸던 강의로써
먼저 답변을 드리고
이에 대해서 추가적인 질문이 있다면
그것에 대해 자세하게 답변드리는 것이 가장 효율적인 방법이라 생각합니다.
그리고 아래와 같이 몇 가지만 정정하고 싶습니다.
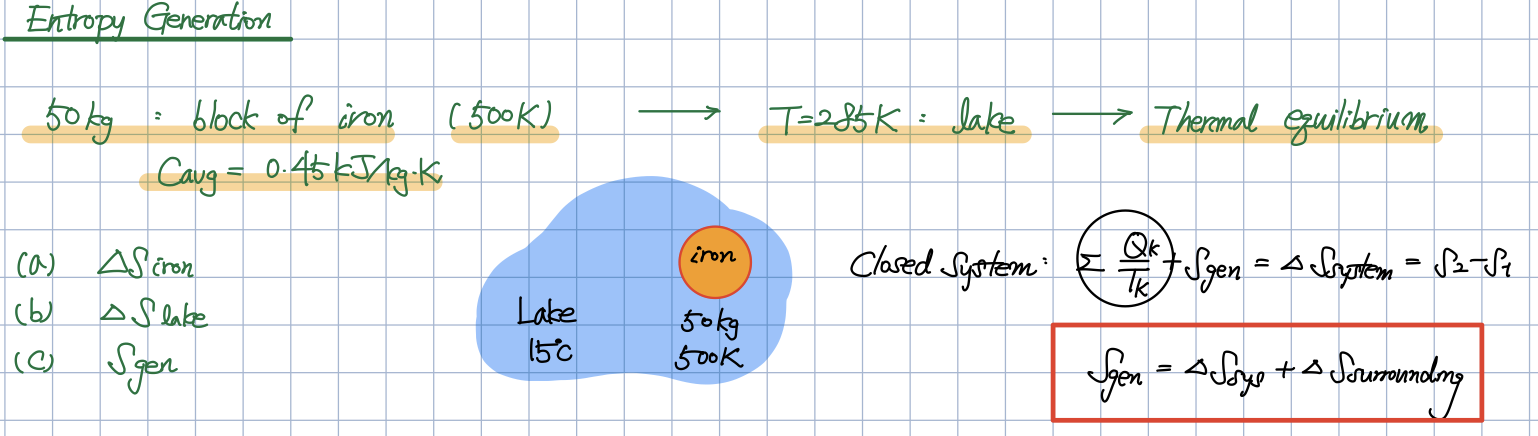
- \Delta{S}=mcln(\frac{T2}{T1}) (엔트로피 변화량)
- 호수가에 돌을 던질 때는 열전달이 발생하고, 현실세계에서의 열전달은 대부분 irreversible 과정이기 때문에 호수의 온도가 일정하다는 이유로 열역학적 과정을 reversible로 보는 것은 조금 수정이 필요합니다.
먼저 위의 영상을 보시면서
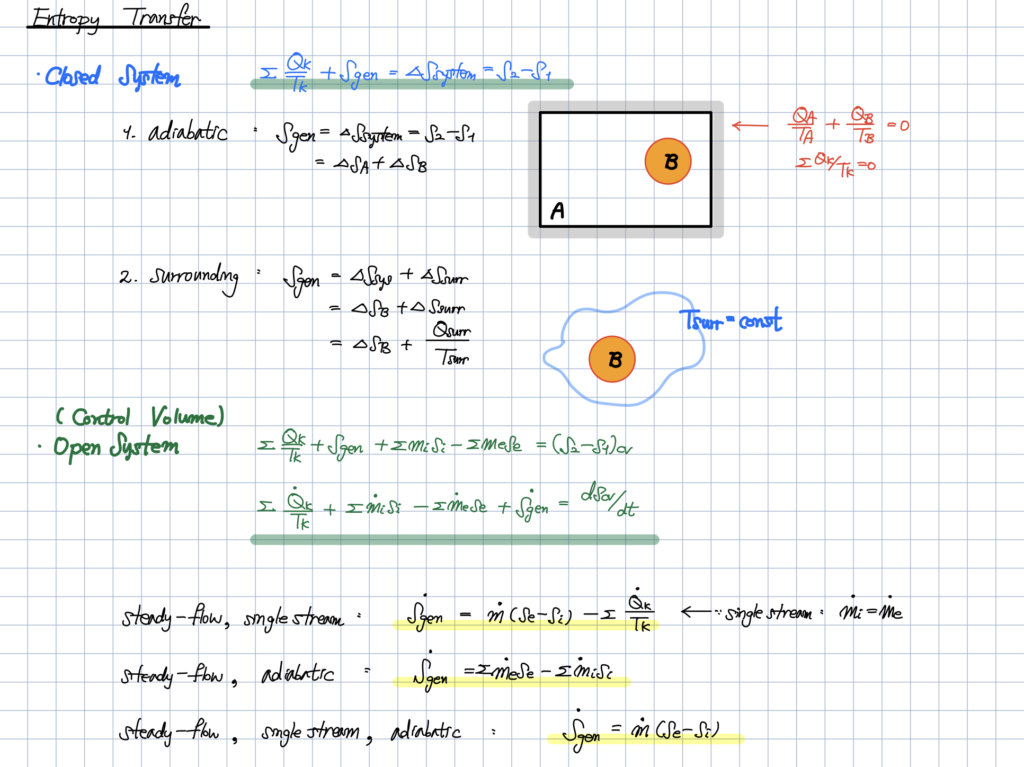
Entropy Transfer의 개념에 대한 이해를 하셔야 합니다.
지금 질문 주신 것을 보면
- Reversible/Irreversible의 개념뿐 아니라
- 밀폐계/개방계에 대한 개념도 살짝 헷갈리신 것 같습니다.
호수에 뜨거운 돌덩이를 떨어뜨리는 문제의 경우
기본적으로
- 밀폐계이면서
- Surrounding의 개념으로 접근하는 것이 일반적입니다.
(개방계일 것 같지만요.)
Entropy Transfer의 개념에 대해서 이해를 하셨다면,
첫 번째 질문의 핵심인
각 개체에서의 온도를 어떻게 처리해줘야 하는지에 대해서 이해를 하셔야 합니다.
두 번째 영상에서는
(질문하신 내용인)
호수에 뜨거운 물체를 떨어 뜨리면서 생기는
- 열전달에 의한 엔트로피의 변화량 및 생성량
을 구하는 문제를 풀어드리고 있습니다.
위의 강의를 통해
- 온도를 어떻게 처리해줘야하는지에 대한 답변은 물론
- 전반적인 엔트로피 평형식에 대한 적용에 대한 연습을 하실 수 있으실 겁니다.
이는 올해 오픈한
“열역학 제대로 끝내기 (엔트로피 편)” 중의 일부인데요.
열역학 제대로 끝내기를 수강하신다면,
엔트로피 전달 및 생성에 대한
여러 가지 문제를 같이 풀어봄으로써
열역학 한방에 끝내기에서
충분히 다루지 못했던 토픽에 대한
다양한 내용을 공부하실 수 있으실 겁니다.
아래와 같이 필기노트도 첨부드리니
같이 공부해보시길 바랍니다.

두 번째 질문에 대한 답변
밀폐계에서의 일과
개방계에서의 일에 대한
차이를 질문 주셨습니다.
아래의 링크를 통해 공부하시고
https://godjunpyo.com/열역학-개방계에서의-일은-왜-vdp일까/
이후에는
아래의 갓준표 역학 콘서트 및 질의응답 영상을 통해
내용을 정리해보시길 바랍니다.
세 번째 질문에 대한 답변
Steady state란
시간에 대해서 변하지 않는
일정한 유동을 가지는 상황을 말합니다.
하지만 내부에너지는
이상기체의 경우 온도에 대한 함수이기 때문에
(일반적인 물질의 경우 더욱 다양한 변수들에 의해 결정되는 값)
정상상태라고 해도 내부에너지가 0이라고 말하기는 어려울 것 같습니다.
위의 영상들을 통해 이해하실 수 있을 거라 생각합니다.
dE/dt가 0이라는 것은
시간에 따른 에너지의 변화량이 0라는 것이지
시스템의 에너지값 자체가 0이라는 말이 아님을
꼭 기억하시길 바랍니다.
네 번째 질문에 대한 답변
질문하신 내용은
개방계에서의 엔트로피 전달과 관련합니다.
첫 번째 답변에서 보여드렸던
아래의 그림을 통해
충분히 이해하실 수 있을 거라 생각합니다.